Läkemedelskandidater
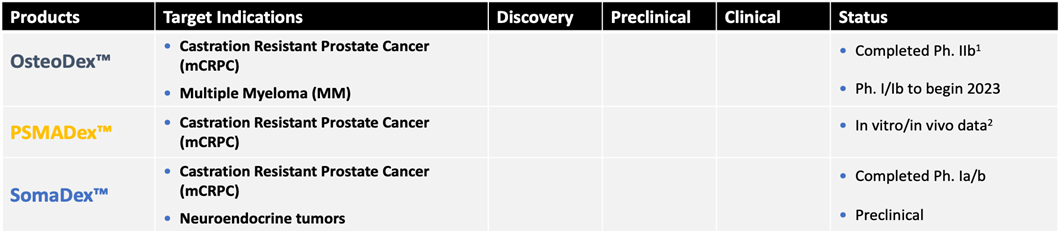
Dextechs huvudkandidat ODX har framgångsrikt utvecklats till och med fas 2b och står inför en fas 3 studie (mCRPC). Genomförda kliniska studier visar mycket låg toxicitet med få och lindriga biverkningar samt bromsande effekt på sjukdomen (stabil sjukdom). En tredjedel av patienterna visade reduktion av skelettmetastaser. Fas 2 studien är publicerad i Europas ledande cancerjournal, EJC (2023). Det faktum att fas 2 studien genomförd med relativt få patienter har kunnat påvisa ca 1/3 del med reduktion av skelettmetastaser talar statistiskt för framgång i en fas 3 studie med ett större patientunderlag. Genomsnittlig responsfrekvens hos cancerläkemedel är ca 30 %.
På grund av flera likheter mellan mCRPC och multipelt myelom, undersöks ODX även för behandling av multipelt myelom i en fas 1a studie (2023).
Läkemedelskandidater
Genom Bolagets patenterade teknologiplattform, GuaDex, har 3 olika läkemedelskandidater utvecklats.
OsteoDex (ODX) är Bolagets huvudkandidat för behandling av skelettmetastaser från prostatacancer (mCRPC). ODX har genomgått en klinisk fas2b studie (2020) och står inför klinisk fas 3.
SomaDex, är naturligt somatostatin-14 kopplat till GuaDex med unik stabilitet och bibehållen receptorbindande förmåga. SomaDex skall användas för behandling av vissa hypofystumörer, neuroendokrina tumörer samt för palliativ behandling vid mCRPC.
PSMA-Dx, är en PSMA specifik tripeptid kopplad till GuaDex. Prostataspecifikt membranantigen (PSMA) finns specifikt på CRPC cellernas cellmembran. PSMA-Dex är en platform för målspecifik behandling av CRPC. Platformen medger möjlighet att välja typ av terapi (radionuklider eller cytostatika). Intresset för PSMA bindande föreningar är idag mycket stort, särskilt efter att Novartis erhållit marknadsgodkännande av sin substans Pluvicto® (EMA, 2022) för radioaktiv behandling av CRPC.
Bolaget ämnar fortsätta den pre-kliniska utvecklingen av PSMA-Dex och undersöka tidiga affärsmöjligheter. PSMA-Dex har globalt patentskydd till 2037. Tabell 2 visar en sammanställning av kandidaterna.
Tabell 2